Para os alunos que estavam dormindo ou não entenderam nada durante a aula... kkkkk
As ligações covalentes, também denominadas ligações moleculares com tendência de receber elétrons, estabelecendo uma ligação de compartilhamento de elétrons das suas camadas de valência.
A ligação covalente pode ocorrer entre os seguintes elementos: hidrogênio, ametais e semimetais. Os metais nunca participam desse tipo de ligação.
Vamos considerar um exemplo simples de ligação covalente: a ligação de formação do gás hidrogênio (H2):
H + H → H2
.jpg)
Observe que ambos os átomos precisavam receber um elétron para completar a sua camada de valência – exceção a Regra do Octeto – e para, dessa forma, ficarem estáveis. Portanto, eles compartilharam seus elétrons e, desse modo, ambos passaram a dispor de dois elétrons.
Esse compartilhamento de elétrons é o que diferencia esse tipo de ligação da ligação iônica, na qual há transferência de elétrons.
Veja na figura abaixo mais dois exemplos desse caso:
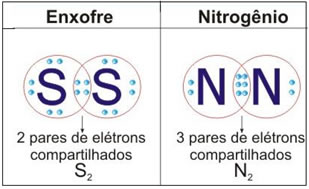
Nesse tipo de ligação há a formação de moléculas, que podem ser representadas por suas respectivas fórmulas moleculares, isto é, a representação mais simples que indica quantos átomos de cada elemento têm na molécula. Alguns exemplos de fórmulas moleculares são: H2, S2, O2, N2, H2O, CO2, etc.
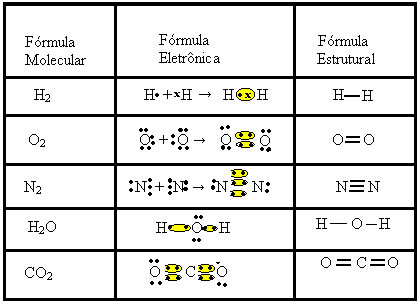
A ligação covalente pode ser representada ainda por duas outras fórmulas:
- Fórmula Eletrônica ou Fórmula de Lewis: nessa fórmula aparecem também os elétrons da camada de valência de cada átomo e a formação de pares eletrônicos. Esses elétrons são simbolizados pelos sinais . ou x;
- Fórmula Estrutural Plana ou Fórmula Estrutural de Couper: mostra as ligações dos elementos, sendo que cada par compartilhado corresponde a um traço. Se for apenas um traço chamamos de ligação simples; se forem dois, ligação dupla; e se forem três traços, ligação tripla.
Observe outros exemplos de ligações covalentes, sendo representadas por essas três fórmulas químicas:
Este texto foi adaptado do texto original escrito por Jennifer Fogaça (Graduada em Química)
Ligação covalente: ligação entre não-metais e não-metais ou não-metais e Hidrogênio.Exemplos:
HCl
SiO2
CO2
N2
H2
02
H2O
NH3
CH4
H2S
PH3
Atenção: Qualquer um dos exemplos acima podem constar nas atividades avaliativas....
Nenhum comentário:
Postar um comentário