Acorda na aula pô...
Ligação Iônica
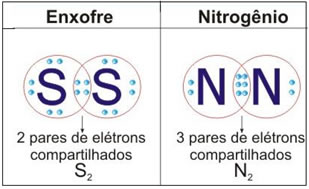
As Ligações iônicas são as ligações químicas que ocorrem entre os átomos quando estes reagem entre si a fim de alcançarem a estabilidade que, segunda a Teoria do Octeto, compõem 8 elétrons na última camada ou camada de valência. Diferentemente das ligações covalentes, em que há o compartilhamento de elétrons, nas ligações iônicas os elétrons são doados ou recebidos pelos átomos.
A ligação iônica é produzida entre íons (cátions e ânions), daí o termo "iônica". Vale lembrar que os Íons são átomos que possuem uma carga elétrica por adição ou perda de um ou mais elétrons.
As ligações iônicas, geralmente estabelecida entre um metal e um ametal (não metal), formam os compostos iônicos: elementos sólidos, duros e quebradiços que apresentam alto pontos de fusão e ebulição, além de conduzirem corrente elétrica quando dissolvidas em água. Alguns exemplo de ligações iônicas:
- Na+Cl- = NaCl (Cloreto de sódio ou sal de cozinha)
- Mg+Cl- = MgCl2 (Cloreto de Magnésio)
- Al+O- = Al2O3 (Óxido de Alumínio)
Texto adaptado do site TodaMatéria
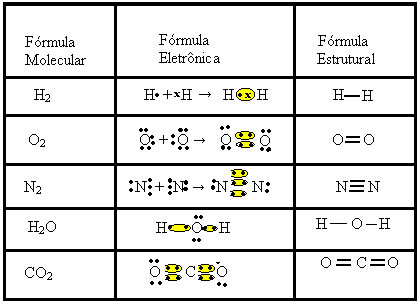
Fórmula Eletrônica ou Diagrama de Lewis

Veja a ilustração dessa ligação iônica:

Ligação iônica: ligação entre metais e não metais
Exemplos:
NaCl
MgCl2
MgO
Al2O3
MgF2
Ca3N2
KCl
NaOH
CaF2
CaBr2
Atenção: estes exemplos podem ser pedidos nas avaliações

.jpg)